在日益增長(zhǎng)的病患需求����、不斷推進(jìn)的監(jiān)管制度和大量資金投入研發(fā)及合作的情況下,國(guó)內(nèi)的細(xì)胞治療產(chǎn)業(yè)發(fā)展迅速���,目前已形成了近百家不同規(guī)模的公司��。南京傳奇生物的CAR-T療法獲得國(guó)內(nèi)首個(gè)按藥物申報(bào)的臨床批件��。截至2018年5月���,另有13家企業(yè)的19個(gè)CAR-T項(xiàng)目臨床申請(qǐng)獲得CDE受理���,絕大多數(shù)都是以CD19為靶點(diǎn)。預(yù)計(jì)未來(lái)3-5年��,國(guó)產(chǎn)CAR-T產(chǎn)品將陸續(xù)上市�����。
1.CAR-T細(xì)胞免疫療法簡(jiǎn)介
CAR-T細(xì)胞免疫療法(Chimeric Antigen Receptor T-Cell Immunotherapy)指的是嵌合抗原受體T細(xì)胞免疫療法��,是細(xì)胞免疫療法的一種����,也是目前臨床上較為有效的治療惡性腫瘤的方式之一。
1.1 治療原理及特點(diǎn)
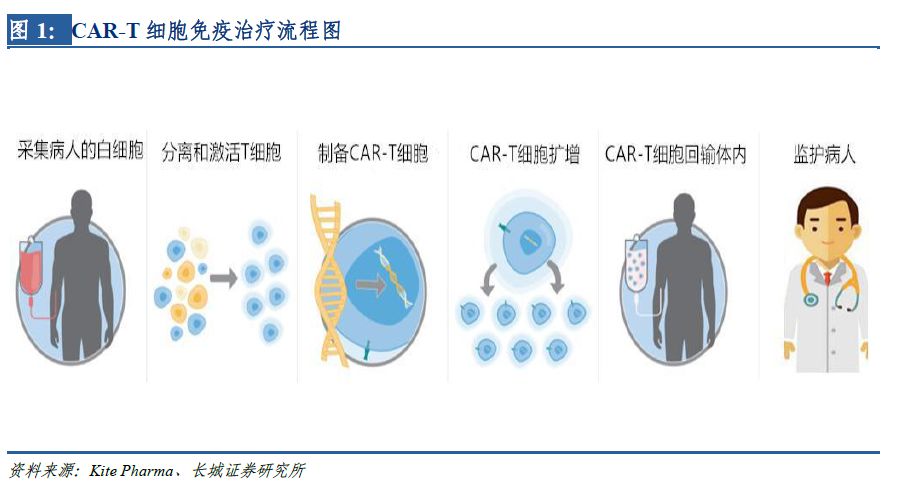
CAR-T的治療原理是從腫瘤患者外周血中分離出自身T細(xì)胞���,通過(guò)基因轉(zhuǎn)導(dǎo)的方法���,將能特異性識(shí)別腫瘤抗原的CAR結(jié)構(gòu)轉(zhuǎn)入T細(xì)胞,體外擴(kuò)增培養(yǎng)后����,回輸患者體內(nèi)�����,殺傷具有相應(yīng)特異性抗原的腫瘤細(xì)胞����。細(xì)胞免疫治療的本質(zhì)上是通過(guò)人體自身免疫系統(tǒng)對(duì)病變組織進(jìn)行攻擊���,故治療效果更為顯著,潛在的毒副作用相對(duì)更可控����。因輸入的免疫細(xì)胞可在患者體內(nèi)增殖,故治療的持久性也更有保障�����。
CAR-T細(xì)胞免疫治療在臨床試驗(yàn)中顯示出良好的靶向性����、殺傷性和持久性,在治療血液腫瘤方向有突破性進(jìn)展�����,并且正在嘗試用于實(shí)體瘤,具有廣闊的發(fā)展空間����。
1.2 較傳統(tǒng)療法優(yōu)勢(shì)顯著
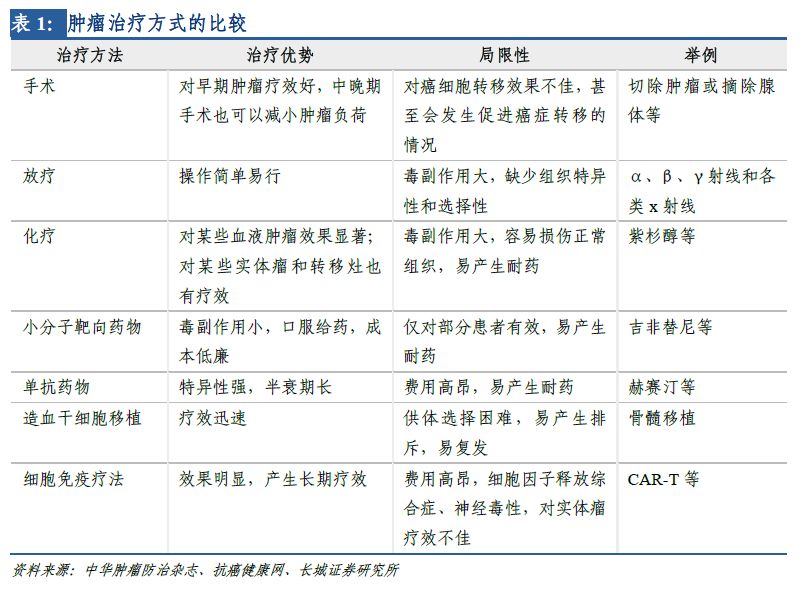
傳統(tǒng)腫瘤治療方法主要有:手術(shù)切除、放化療����、小分子靶向藥物、單抗藥物以及造血干細(xì)胞移植�����。其中�����,手術(shù)切除僅對(duì)早期患者有效�����,若癌細(xì)胞轉(zhuǎn)移則效果不佳����;放化療較普遍,但選擇性差���,對(duì)正常組織損傷大����;靶向藥物(包括小分子和單抗)綜合療效較好,毒副作用相對(duì)較小���,但也面臨刺激腫瘤細(xì)胞基因變異����、產(chǎn)生藥物耐受性等問(wèn)題��。造血干細(xì)胞移植療效迅速�����,但往往供體選擇困難���,且術(shù)后易發(fā)生排斥反應(yīng)。細(xì)胞免疫療法是腫瘤治療最前沿領(lǐng)域��,臨床數(shù)據(jù)顯示���,相較其它腫瘤治療方法��,CAR-T療法具備以下多方面優(yōu)勢(shì):
?更“精準(zhǔn)”:由于CAR-T細(xì)胞是應(yīng)用基因修飾病人自體的T細(xì)胞��,利用抗原-抗體結(jié)合的機(jī)制���,能克服腫瘤細(xì)胞通過(guò)下調(diào)MHC分子表達(dá)以及降低抗原遞呈等免疫逃逸��。
?更“靈活”:CAR-T既可以利用腫瘤細(xì)胞的蛋白質(zhì)抗原��,又可利用腫瘤細(xì)胞的糖脂類(lèi)非蛋白質(zhì)抗原�����,擴(kuò)大了腫瘤抗原靶點(diǎn)范圍�����。
?更“廣譜”:鑒于很多腫瘤細(xì)胞表達(dá)相同的腫瘤抗原�����,針對(duì)某一種腫瘤抗原的CAR基因構(gòu)建一旦完成�����,便可以被廣泛利用���。
?更“持久”:通過(guò)基因工程修飾可在CAR-T結(jié)構(gòu)中加入促進(jìn)T細(xì)胞增殖與活化的基因序列����,能保證T細(xì)胞進(jìn)入人體后還可以增殖���。CAR-T細(xì)胞具有免疫記憶功能�����,可以長(zhǎng)期在體內(nèi)存活����。
1.3 目前上市產(chǎn)品
2017年����,F(xiàn)DA批準(zhǔn)了2個(gè)CAR-T產(chǎn)品上市:
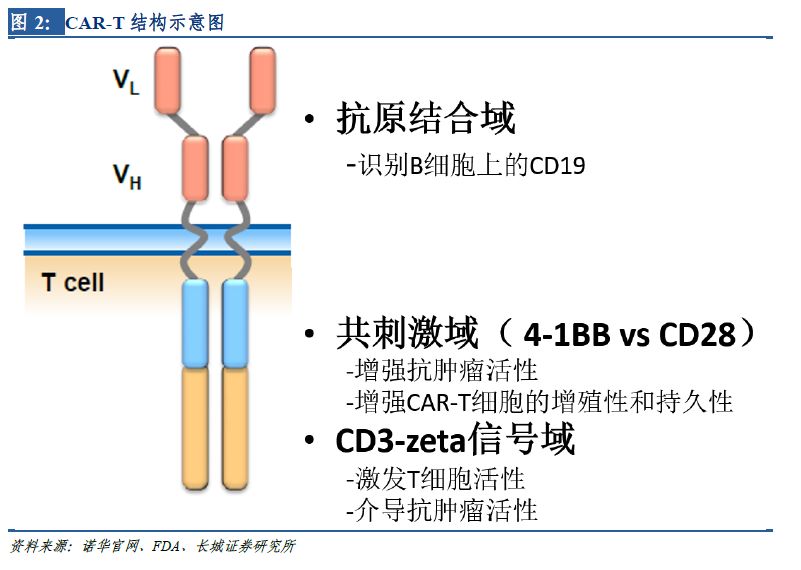
諾華的CAR-T療法Kymriah(Tisagenlecleucel����,CTL019)、���,Kite Pharma 的CAR-T產(chǎn)品Yescarta���。2個(gè)產(chǎn)品具有類(lèi)似的結(jié)構(gòu)�����。首先����,都以CD19 蛋白為靶點(diǎn)��。CD19在B細(xì)胞白血病和淋巴瘤中廣泛表達(dá)��,是CAR-T技術(shù)研究相對(duì)成熟也是研發(fā)最熱門(mén)的靶點(diǎn)����;其次,皆為第二代CAR-T�����,相比第一代多了細(xì)胞內(nèi)共刺激分子�����,有利于增強(qiáng)抗腫瘤活性,且CAR-T細(xì)胞的增殖性和持久性都更強(qiáng)���。第二代CAR-T有較多的臨床數(shù)據(jù)支持�����,穩(wěn)定性高且技術(shù)工藝較為成熟��,是目前的主流技術(shù)��。未來(lái)����,隨著新結(jié)構(gòu)在臨床上的試驗(yàn)推廣及生產(chǎn)工藝的改進(jìn)���,第三代�����、第四代CAR-T產(chǎn)品更為優(yōu)良的療效值得期待���。
2.國(guó)內(nèi)外研發(fā)動(dòng)態(tài)
2.1 CAR-T
2017年���,CAR-T研究進(jìn)入白熱化階段����,主要由歐美制藥企業(yè)引領(lǐng)。其中�����,諾華��、KitePharma和JunoTherapeutics是該領(lǐng)域的三只領(lǐng)頭羊����,無(wú)論從產(chǎn)品研發(fā)、臨床研究還是學(xué)術(shù)推廣上都有較為深厚的積淀���。
諾華和KitePharma
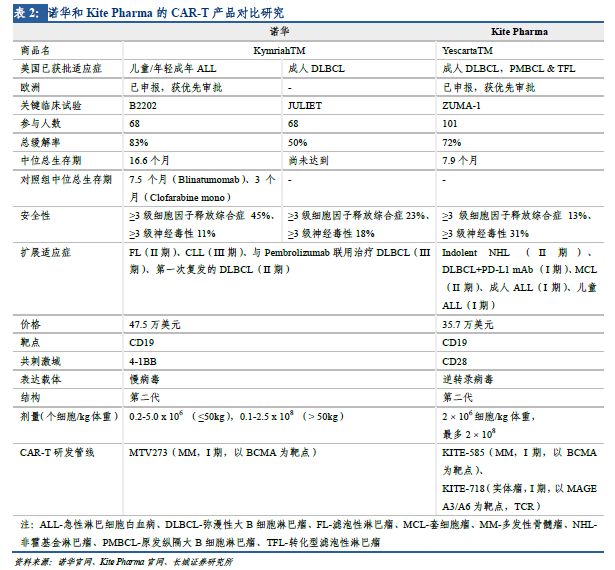
諾華和KitePharma處于全球CAR-T研發(fā)第一梯隊(duì)�����,分別上市了全球首個(gè)和第二個(gè)CAR-T產(chǎn)品��,在腫瘤免疫治療上具有劃時(shí)代的意義��。兩個(gè)企業(yè)均就已在美獲批的適應(yīng)癥向歐洲EMA提交了Kymriah和Yescarta的上市申請(qǐng)��,且就諸多其他適應(yīng)癥積極開(kāi)展臨床試驗(yàn)���,若實(shí)驗(yàn)進(jìn)展順利��,預(yù)計(jì)未來(lái)5年可獲批治療其他多種類(lèi)型腫瘤����。同時(shí)����,兩家公司也在開(kāi)發(fā)針對(duì)其他靶點(diǎn)的CAR-T產(chǎn)品(見(jiàn)表2),主要是以BCMA為靶點(diǎn)治療多發(fā)性骨髓瘤�����,均處于臨床I期�����。
Juno和Celgene
JunoTherapeutics致力于腫瘤細(xì)胞免疫研究�����,是該領(lǐng)域的先驅(qū)公司之一��,其JCAR015進(jìn)度靠前,本有希望成為第一款獲批的CAR-T產(chǎn)品�����。但在2016年7月和11月����,相繼有3名和2名急性淋巴細(xì)胞白血病患者在接受JCAR015治療的II期臨床試驗(yàn)時(shí)�����,因神經(jīng)毒性引發(fā)的腦水腫死亡�����,臨床試驗(yàn)叫停��。在經(jīng)歷了幾個(gè)月的研究分析后����,公司并沒(méi)能找到確切的原因,因此于2017年3月正式宣布放棄JCAR015����。競(jìng)爭(zhēng)對(duì)手諾華和KitePharma獲得領(lǐng)先����。盡管JCAR015出師未捷��,Juno的CAR-T研發(fā)管線依然十分豐富��。同樣以CD19為靶點(diǎn)治療非霍基金淋巴瘤的還有2個(gè)產(chǎn)品-JCAR017和JCAR014�����,均處于臨床I期�����。不同于JCAR015使用CD28作為共刺激結(jié)構(gòu)域��、逆轉(zhuǎn)錄病毒作為表達(dá)載體(類(lèi)似KitePharma技術(shù))�����,JCAR017和JCAR014均以4-1BB和慢病毒作為共刺激結(jié)構(gòu)域和表達(dá)載體(類(lèi)似諾華技術(shù))��。JCAR017治療彌漫性大B細(xì)胞淋巴瘤(DLBCL)的I期臨床數(shù)據(jù)顯示���,3個(gè)月和6個(gè)月內(nèi)���,分別有74%和50%的患者得到完全緩解����,且3級(jí)或以上的細(xì)胞因子釋放綜合癥和神經(jīng)毒性的發(fā)生率僅為1%和14%���,安全性良好。公司計(jì)劃于2018年提交上市申請(qǐng)��。
2.2 未來(lái)的發(fā)展方向-新靶點(diǎn)���、新適應(yīng)癥
目前��,以CD19為靶點(diǎn)的CAR-T產(chǎn)品研究相對(duì)較深入���,已上市的2個(gè)產(chǎn)品均是以CD19為靶點(diǎn)治療血液腫瘤。全球來(lái)看�����,CAR-T的研發(fā)管線迅速擴(kuò)張����,既包括新靶點(diǎn)的探索�����,如BCMA����、CD123���、CD33等�����;也包括新適應(yīng)癥的拓展���,如由血液腫瘤向?qū)嶓w瘤進(jìn)階。全球已有多家公司的項(xiàng)目推進(jìn)到了臨床階段����,預(yù)計(jì)未來(lái)將陸續(xù)有針對(duì)不同腫瘤的CAR-T產(chǎn)品問(wèn)世。
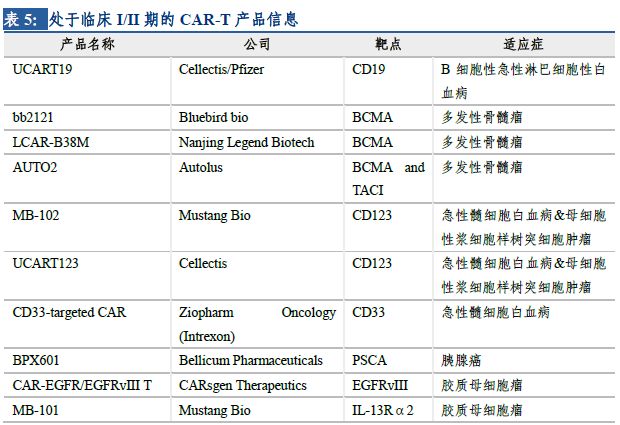

2.3 國(guó)內(nèi)發(fā)展逐漸步入正軌
伴隨CAR-T在國(guó)際上的快速發(fā)展����,我國(guó)細(xì)胞免疫療法也大致經(jīng)歷了寬松放開(kāi)(第一階段)、“魏則西”事件后的短暫停滯(第二階段)以及現(xiàn)在的大浪淘沙、行業(yè)洗牌(第三階段)���。行業(yè)有望向有序�����、規(guī)范���、健康的方向穩(wěn)步前進(jìn)。
?第一階段-全面放開(kāi)��、秩序混亂(2016年以前)
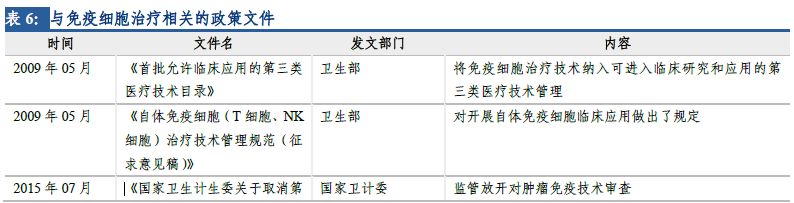
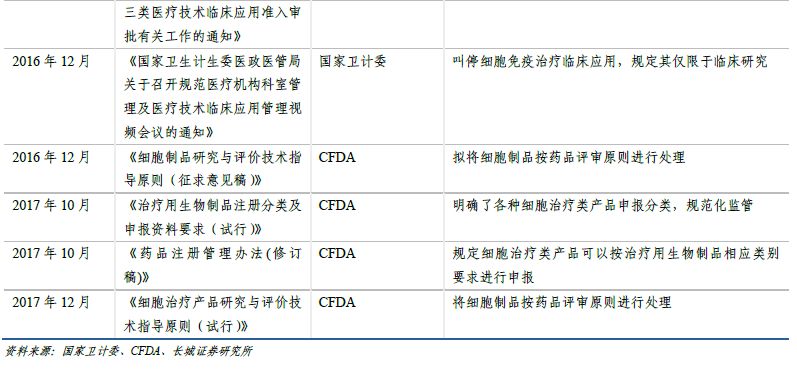
由于CAR-T療法具有特殊性�����,不同于常規(guī)藥物����,2009年衛(wèi)生部將免疫細(xì)胞治療技術(shù)納入可進(jìn)入臨床研究和應(yīng)用的第三類(lèi)醫(yī)療技術(shù)管理���。由于監(jiān)管體制相對(duì)寬松��,部分醫(yī)療機(jī)構(gòu)科室在沒(méi)有經(jīng)過(guò)衛(wèi)計(jì)委批準(zhǔn)的情況下����,紛紛開(kāi)展免疫細(xì)胞治療項(xiàng)目,各種形式的臨床試驗(yàn)和臨床應(yīng)用項(xiàng)目迅速增加��。
?第二階段-緊急叫停����、舉步維艱(2016年)
2016年4月,“魏則西”事件經(jīng)過(guò)媒體宣傳持續(xù)發(fā)酵����,在社會(huì)上造成巨大影響,免疫細(xì)胞治療技術(shù)的濫用引起監(jiān)管部門(mén)高度重視�����。5月���,衛(wèi)計(jì)委召開(kāi)關(guān)于規(guī)范醫(yī)療機(jī)構(gòu)科室管理和醫(yī)療技術(shù)管理工作的電視電話會(huì)議����,明確要求所有類(lèi)型的免疫細(xì)胞治療技術(shù)停止應(yīng)用于臨床治療�����,僅限于臨床研究。包括CAR-T在內(nèi)的免疫細(xì)胞治療在國(guó)內(nèi)進(jìn)入停滯期�����。
?第三階段-有序放開(kāi)�����、步入正軌(2017年至今)
2016年12月�����,CDE發(fā)布了關(guān)于《細(xì)胞制品研究與評(píng)價(jià)技術(shù)指導(dǎo)原則》(征求意見(jiàn)稿)的通知����,根據(jù)征求意見(jiàn)稿�����,細(xì)胞制品未來(lái)將按藥品評(píng)審原則進(jìn)行處理����。2017年12月,《細(xì)胞治療產(chǎn)品研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》發(fā)布�����,提出了細(xì)胞治療產(chǎn)品從早期研發(fā)到生產(chǎn)、從藥學(xué)研究��、非臨床研究�����,到臨床研究階段應(yīng)遵循的一般原則和基本要求����,初步規(guī)范了細(xì)胞治療產(chǎn)品的研究、開(kāi)發(fā)與評(píng)價(jià)方法���,未來(lái)仍將逐步完善���、細(xì)化與修訂。指導(dǎo)原則框架和內(nèi)容科學(xué)合理��,符合細(xì)胞治療產(chǎn)品作為藥品研發(fā)的規(guī)律�����,這是行業(yè)的大洗牌����,促使提高產(chǎn)業(yè)門(mén)檻和監(jiān)管力度���,一方面讓缺乏核心技術(shù)、不符合水準(zhǔn)的企業(yè)自行淘汰�����,另一方面鼓勵(lì)合格研發(fā)機(jī)構(gòu)的細(xì)胞治療產(chǎn)品申報(bào)����,進(jìn)一步推動(dòng)我國(guó)細(xì)胞治療藥品產(chǎn)業(yè)的發(fā)展和壯大。
2.4中國(guó)位列第一梯隊(duì)����,熱門(mén)靶點(diǎn)競(jìng)爭(zhēng)激烈
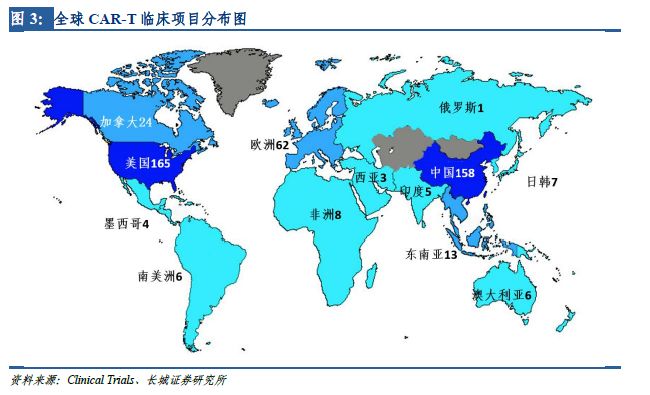
在全世界范圍內(nèi),CAR-T療法的臨床試驗(yàn)正在大幅增加��。美國(guó)是開(kāi)展CAR-T臨床試驗(yàn)最早的國(guó)家�����,據(jù)ClinicTrail.gov的統(tǒng)計(jì)數(shù)據(jù)�����,截至2017年4月����,美國(guó)登記開(kāi)展CAR-T臨床研究達(dá)165項(xiàng),居全球首位�����。中國(guó)緊跟其后����,共計(jì)登記開(kāi)展了158項(xiàng)CAR-T研究,數(shù)量上僅次于美國(guó)����,超過(guò)全球注冊(cè)總數(shù)的40%,并呈逐年遞增趨勢(shì)���。
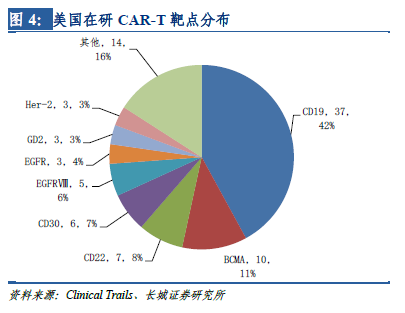
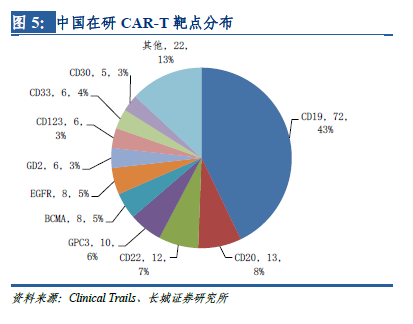
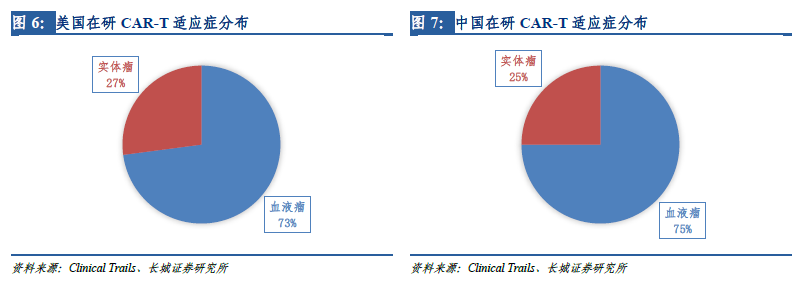
靶點(diǎn)決定適應(yīng)癥����,從適應(yīng)癥上看�����,有75%的在研CAR-T項(xiàng)目擬用于白血病、淋巴瘤等血液腫瘤�����,僅有小部分的在研項(xiàng)目針對(duì)肝癌����、肺癌等實(shí)體腫瘤,與美國(guó)在研CAR-T項(xiàng)目的適應(yīng)癥分布也非常類(lèi)似����。這是因?yàn)樵谠缙诘呐R床試驗(yàn)中,CAR-T僅被證實(shí)可以顯著改善晚期血液腫瘤患者的預(yù)后��,但在實(shí)體瘤上的突破直到近幾年才有所進(jìn)展���,各種實(shí)體瘤是CAR-T繼血液腫瘤之后的重要發(fā)展方向�����。
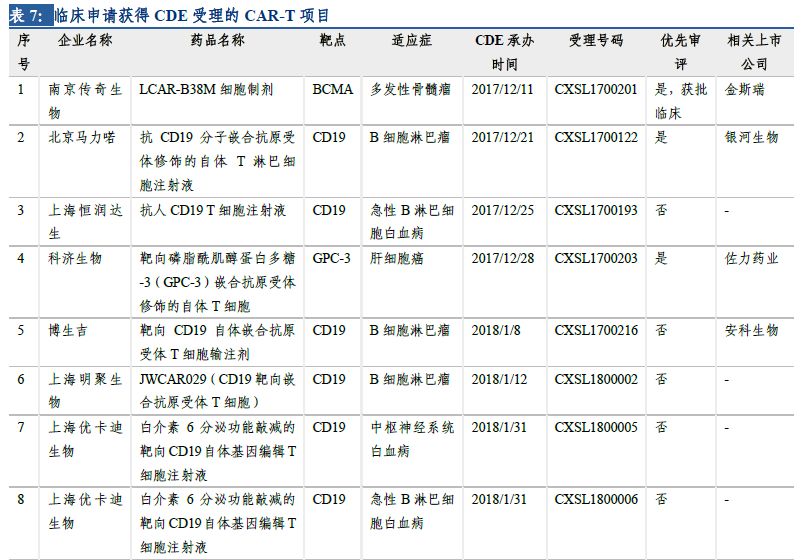
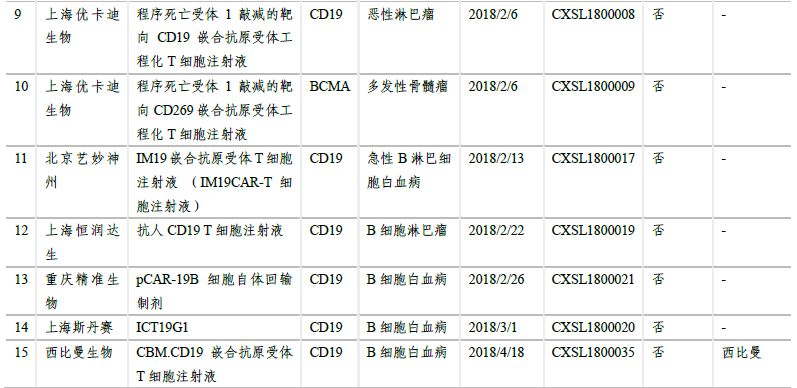
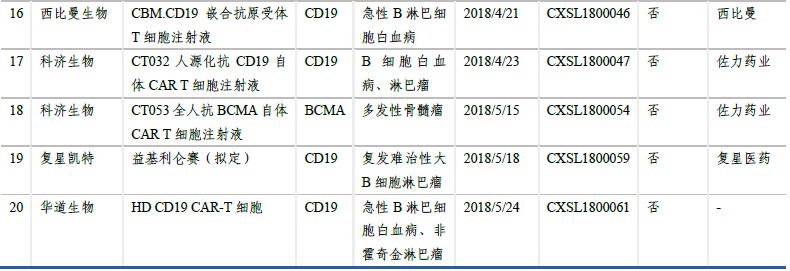
2.5 多個(gè)產(chǎn)品臨床申請(qǐng)獲得受理���,3個(gè)納入優(yōu)先審評(píng)
在日益增長(zhǎng)的病患需求、不斷推進(jìn)的監(jiān)管制度和大量資金投入研發(fā)及合作的情況下���,國(guó)內(nèi)的細(xì)胞治療產(chǎn)業(yè)發(fā)展迅速���,目前已形成了近百家不同規(guī)模的公司,且有多家已建立產(chǎn)業(yè)化基地�����,覆蓋了從細(xì)胞存儲(chǔ)到細(xì)胞制劑制備����、細(xì)胞治療技術(shù)研究等各方面。CAR-T細(xì)胞治療在技術(shù)上愈發(fā)成熟����、安全、高效��,制備工藝和臨床使用規(guī)程也將更加標(biāo)準(zhǔn)化����、自動(dòng)化、精準(zhǔn)化��。臨床申報(bào)方面���,南京傳奇生物的CAR-T療法獲得國(guó)內(nèi)首個(gè)按藥物申報(bào)的臨床批件�����。截至2018年5月��,另有13家企業(yè)的19個(gè)CAR-T項(xiàng)目臨床申請(qǐng)獲得CDE受理��,絕大多數(shù)都是以CD19為靶點(diǎn)�����。預(yù)計(jì)未來(lái)3-5年����,國(guó)產(chǎn)CAR-T產(chǎn)品將陸續(xù)上市。
目前CAR-T是腫瘤精準(zhǔn)治療的熱點(diǎn)前沿領(lǐng)域�����,國(guó)內(nèi)有近百家不同規(guī)模的公司都在從事自主或合作研發(fā)���,未來(lái)免疫細(xì)胞治療將成為一片紅海市場(chǎng)�����,最早上市的產(chǎn)品可占有搶占市場(chǎng)的先發(fā)優(yōu)勢(shì)���。若能領(lǐng)先外資企業(yè)產(chǎn)品在國(guó)內(nèi)上市,更有利于在激烈的市場(chǎng)競(jìng)爭(zhēng)中立足��。然而目前CAR-T細(xì)胞制備仍然依賴(lài)傳統(tǒng)的人工操作��,細(xì)胞質(zhì)量和穩(wěn)定性都難以保證���,療效也會(huì)因此大打折扣��。CAR-T按照藥物申請(qǐng)上市���,必然要通過(guò)生物制品質(zhì)量控制,可預(yù)見(jiàn)自動(dòng)化生產(chǎn)是未來(lái)的大趨勢(shì)���,一方面可滿足監(jiān)管機(jī)構(gòu)對(duì)藥品制備的要求�����,另一方面便于實(shí)施工藝優(yōu)化��,在大規(guī)模產(chǎn)業(yè)生產(chǎn)條件下(如數(shù)百上千份)降低生產(chǎn)成本���,才能在競(jìng)爭(zhēng)中立于不敗之地�����。